Este medicamento está indicado como um coadjuvante de dieta e exercícios físicos para melhorar o controle glicêmico em pacientes com diabetes tipo II (E11) (diabetes mellitus não insulino-dependente, DMNID). Stanglit está indicado em monoterapia e também para uso combinado com sulfonilureia, metformina, ou insulina, quando dieta e exercício associados a um agente único não resultam em controle adequado da glicemia. O acompanhamento de diabetes tipo II deverá também incluir aconselhamento nutricional, redução de peso quando indicado e exercícios. Estas medidas são importantes não só para tratamento primário do diabetes tipo II, mas também para manter a eficácia da tratamento medicamentoso.
Este medicamento é contraindicado em pacientes com hipersensibilidade ao cloridrato de piglitazona ou a qualquer componente de sua formulação. É contraindicada a iniciação do medicamento em pacientes com insuficiência cardíaca estabelecidos nas classes III ou IV do New York Heart Association (NYHA).
Stanglit deve ser administrado uma vez ao dia, independentemente da alimentação. O controle do tratamento antidiabético deve ser individualizado. Idealmente, a resposta ao tratamento deve ser avaliada usando-se a hemoglobina glicosilada (HbA1c), que é um melhor indicador do controle glicêmico a longo prazo quando comparado com glicemia de jejum unicamente. HbA1c reflete a glicemia dos últimos 2 a 3 meses. No uso clínico, recomenda-se que o paciente seja tratado com Stanglit por um período de tempo adequado para se avaliar as alterações de HbA1c (3 meses), a não ser que o controle glicêmico se deteriore. Ao iniciar Stanglit ou após aumento da dose, os pacientes deverão ser cuidadosamente monitorados por causa da retenção de fluídos relatado nos eventos adversos (ver “5. Advertências e Precauções”). O medicamento deve ser administrado via oral. Esquecimento de dose (dose omitida): no caso de esquecimento de uma dose, orientar o paciente a tomar assim que possível. Se estiver próximo ao horário da dose seguinte, a dose esquecida deve ser desprezada e deve-se voltar ao esquema normal. Não devem ser tomadas duas doses ao mesmo tempo.
Monoterapia A monoterapia com Stanglit em pacientes sem controle adequado de dieta e exercícios pode ser iniciada com 15 mg ou 30 mg uma vez ao dia. Para pacientes que respondem inadequadamente à dose inicial, a dose pode ser aumentada para 45 mg, uma vez ao dia. Em pacientes que não respondem adequadamente a monoterapia, pode ser considerada uma terapia combinada.
Terapia combinada Stanglit em combinação com outro medicamento, pode ser iniciado nas doses de 15 mg ou 30 mg, uma vez ao dia. A dose do outro medicamento em uso pode ser mantida com a introdução do tratamento com Stanglit. sulfonilureia: se o paciente apresentar hipoglicemia, a dose da sulfonilureia deverá ser diminuída. metformina: é improvável que seja necessário ajuste na dose de metformina devido a hipoglicemia durante a combinação com Stanglit. insulina: nos pacientes que estejam recebendo Stanglit e insulina, a dose de insulina pode ser diminuída em torno de 10 a 25% se o paciente apresentar hipoglicemia, ou se as concentrações de glicose plasmática diminuírem para valores menores que 100 mg/dL em jejum. Maiores ajustes deverão ser individualizados, baseando-se na resposta de diminuição da glicose. Dose máxima recomendada: as doses de Stanglit não devem exceder a 45 mg em monoterapia ou em combinação com sulfonilureia, metformina ou insulina. Nenhum estudo clínico foi conduzido com doses maiores que 30 mg uma vez ao dia em terapia combinada. Não é recomendado o ajuste de doses em pacientes com insuficiência renal (ver “3. Características Farmacológicas - Farmacocinética – metabolismo”). O tratamento com Stanglit não deve ser iniciado se o paciente mostrar evidência clínica de doença hepática ativa ou aumento de níveis de transaminase sérica (ALT > 2,5 vezes o limite da normalidade) no início do tratamento (ver “5. Advertências e Precauções - geral - efeitos hepáticos” e “3. Características Farmacológicas - população especial - insuficiência hepática”). Recomenda-se a monitoração de enzimas hepáticas em todos os pacientes que estejam iniciando a terapia com Stanglit, bem como periodicamente após o início. Não existem dados sobre o uso de Stanglit em pacientes abaixo de 18 anos de idade, portanto o uso de pioglitazona em pacientes pediátricos não é recomendado. Não há dados disponíveis sobre o uso de pioglitazona em combinação com outra tiazolidinediona.
O QUE DEVO SABER ANTES DE USAR ESTE MEDICAMENTO Informe seu médico antes de você utilizar este medicamento: - se você retiver líquidos (retenção de fluidos) ou tiver problemas de insuficiência cardíaca, especialmente se você tiver mais que 75 anos de idade Se você toma medicamentos antiiflamatórios que também podem causar retenção de fluidos e inchaço, você também deve informar seu médico; - se você apresentar uma doença diabética específica dos olhos, chamada edema macular (inchaço na mácula do olho - parte de trás do olho); - se você possui cistos nos ovários (síndrome dos ovários policísticos) Pode haver um aumento da possibilidade de engravidar, porque você pode ovular novamente enquanto tomar Stanglit® Se isso se aplica a você, use métodos contraceptivos adequados para evitar a possibilidade de uma gravidez não-planejada; - se você apresentar uma doença em seu fígado ou coração Antes de iniciar o tratamento com Stanglit®, uma amostra de seu sangue será retirada para avaliar sua função hepática Esta avaliação pode se repetir periodicamente Alguns pacientes com diabetes mellitus tipo II há muito tempo e doença do coração ou derrame prévio que foram tratados com Stanglit® e insulina apresentaram o desenvolvimento de insuficiência cardíaca Informe seu médico assim que possível se você apresentar sinais de insuficiência cardíaca como perda de fôlego ou rápido aumento de peso ou inchaço localizado (edema) Se você usa Stanglit® associado a outros medicamentos para diabetes, é mais provável que o nível de açúcar no sangue caia abaixo do nível normal (hipoglicemia) Você também pode apresentar redução do volume de sangue (anemia) Fratura dos ossos: Um número maior de fratura nos ossos foi verificado nos pacientes, especialmente mulheres, em tratamento com pioglitazona Seu médico considerará isso quando estiver tratando seu diabetes 2 Crianças: O uso em pacientes abaixo de 18 anos não é recomendado Stanglit® com comida ou bebida: você pode tomar os comprimidos com ou sem comida Você deve engolir os comprimidos com um copo de água Gravidez e amamentação: Informe seu médico se você: - está, acha que está ou planeja engravidar; - está amamentando ou planeja amamentar seu bebê Seu médico informará se você deve descontinuar este medicamento Dirigir ou operar máquinas: pioglitazona não irá afetar sua habilidade de dirigir ou utilizar máquinas, mas preste atenção se você apresentar visão anormal Informação importante sobre alguns excipientes de Stanglit®: Este medicamento contém lactose monoidratada Se você foi informado pelo seu médico que possui intolerância a alguns açúcares, verifique com seu médico antes de tomar Stanglit® Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica Informe seu médico a ocorrência de gravidez na vigência do tratamento ou após o seu término Informar ao médico se está amamentando
Em todo o mundo, mais de 5900 pacientes com diabetes tipo II, participantes de estudos clínicos, foram tratados com pioglitazona. Nos EUA, mais de 4700 receberam pioglitazona em estudos clínicos, mais de 3300 foram tratados por seis meses ou mais e mais de 450 pacientes foram tratados com pioglitazona por um ano ou mais. A incidência geral e os tipos de eventos adversos relatados em estudos clínicos controlados com placebo utilizando a pioglitazona como monoterapia nas doses de 7,5 mg, 15 mg, 30 mg ou 45 mg uma vez ao dia.
Para a maioria dos eventos adversos, a incidência foi semelhante nos grupos tratados com pioglitazona em monoterapia e naqueles tratados em combinação com sulfonilureias, metformina ou insulina. Houve um aumento da ocorrência de edema nos pacientes tratados com pioglitazona e insulina em comparação com insulina isoladamente.
No estudo de pioglitazona em combinação com insulina (n= 379), 10 pacientes tratados com pioglitazona mais insulina desenvolveram dispneia e também, em algum momento durante o tratamento, desenvolveram alteração do peso corporal ou edema. Sete desses 10 pacientes receberam diuréticos para tratar esses sintomas. Isto não foi relatado no grupo tratado com insulina mais placebo. O índice de desistência nos estudos clínicos devido a um evento adverso que não a hiperglicemia, foi similar no grupo de pacientes tratados com placebo (2,8%) e no grupo com pioglitazona (3,3%). Hipoglicemia leve a moderada foi relatada durante a terapia combinada com sulfonilureia ou insulina. Hipoglicemia foi registrada em 1% dos pacientes tratados com placebo e em 2% dos pacientes tratados com pioglitazona combinada com sulfonilureia. Na combinação com insulina, a hipoglicemia foi relatada por 5% dos pacientes em placebo, 8% dos pacientes tratados com 15 mg de cloridrato de pioglitazona e 15% dos pacientes tratados com 30 mg de cloridrato de pioglitazona (ver “5. Advertências e Precauções - Hipoglicemia”). Nos estudos duplo-cego de monoterapia, a anemia foi registrada em < 2% dos pacientes tratados com pioglitazona e 0% dos pacientes em placebo. Quando em combinação com insulina, a anemia foi registrada em 1,6% dos pacientes tanto no grupo tratado com pioglitazona como no grupo placebo. A anemia foi também registrada nos estudos de combinação com sulfonilureia em 0,3% dos pacientes tratados com pioglitazona e 1,6% daqueles em placebo. Em combinação com metformina, a anemia foi relatada em 1,2% dos pacientes tratados com pioglitazona e 0,0% dos pacientes em placebo. Em estudos de monoterapia, edema foi registrado em 4,8% e 1,2% dos pacientes tratados com pioglitazona e placebo, respectivamente. Na combinação com insulina, o edema foi mais frequente nos pacientes tratados com pioglitazona (15,3%) do que nos tratados com placebo (7,0%). Todos os eventos foram considerados de intensidade leve ou moderada (ver “5. Advertências e Precauções – Edema”). Em estudos de tratamento combinado, foi relatado edema em 7,2% dos pacientes tratados com pioglitazona e sulfonilureia em comparação com 2,1% dos pacientes tratados com sulfonilureia isoladamente. Em estudos de combinação com metformina, foi relatado edema em 6,0% dos pacientes tratados com a combinação, comparados com 2,5% dos pacientes tratados com metformina isoladamente. Foram também recebidos novos relatórios de pós-comercialização de início ou piora do edema macular do diabético com diminuição da acuidade visual (ver “5. Advertências e Precauções – Edema Macular”). Em um estudo clínico de 16 semanas de tratamento combinado de insulina e pioglitazona, um número maior de pacientes desenvolveu insuficiência cardíaca congestiva no grupo tratado com a combinação (1,1%) do que no grupo tratado com insulina isoladamente (0,0%) (ver “5. Advertências e Precauções – Insuficiência cardíaca congestiva e outros eventos cardíacos”). Anormalidades laboratoriais Hematológicas: a pioglitazona pode causar redução dos valores de hematócrito e hemoglobina. Em todos os estudos clínicos, os valores médios de hemoglobina caíram cerca de 2 a 4% nos pacientes tratados com pioglitazona. Estas alterações ocorreram, em geral, dentro das primeiras 4 a 12 semanas de tratamento e permaneceram relativamente estáveis após este período. Podem estar relacionadas com o aumento do volume plasmático associado à terapia com pioglitazona e não foram associadas a nenhum efeito clínico hematológico significante. Transaminases séricas: Durante todos os estudos clínicos nos EUA, 14 de 4780 (0,30%) pacientes tratados com pioglitazona tiveram valores de ALT > 3 vezes o limite superior da normalidade. Todos os pacientes acompanhados tiveram elevações reversíveis de ALT. Na população de pacientes tratados com pioglitazona, os valores médios de bilirrubina, AST (aspartato-amino transferase), ALT, fosfatase alcalina e gama GT estavam diminuídos na visita final quando comparados com os respectivos valores basais. Menos de 0,9% dos pacientes tratados com pioglitazona saíram dos estudos americanos devido a testes anormais de funções hepáticas. Em estudos clínicos pré- comercialização, não houveram casos de reações idiossincráticas pelo fármaco levando a insuficiência hepática (ver “5. Advertências e Precauções – efeitos hepáticos”). CPK (creatinina fosfoquinase): em testes laboratoriais exigidos em estudos clínicos, foram observadas elevações esporádicas e transitórias nos níveis de CPK. Uma elevação única e isolada para níveis maiores que 10 vezes o limite superior da normalidade (valores de 2150 a 11400 UI/L) foi observada em 9 pacientes; 6 destes pacientes continuaram a receber pioglitazona, 2 haviam completado o recebimento da medicação do estudo no momento do resultado de valor elevado e um paciente deixou o estudo devido a essa elevação. Houve normalização dessas elevações sem qualquer sequela clínica aparente. A relação entre esses eventos e o tratamento com a pioglitazona é desconhecida. Segue abaixo um resumo das reações adversas ordenadas e agrupadas por frequência:
- Monoterapia com pioglitazona: Reação muito comum (≥ 10%): infecção do trato respiratório superior. Reação comum (≥ 1% e < 10%): dor de cabeça, sinusite, mialgia, alterações dentárias, diabetes mellitus agravada, faringite, anemia e edema.
- Terapia combinada de pioglitazona mais insulina: Reação muito comum (≥ 10%): hipoglicemia e edema. Reação comum (≥ 1% e < 10%): dispneia, alteração do peso, anemia e insuficiência cardíaca congestiva.
- Terapia combinada de pioglitazona mais sulfonilureia: Reação muito comum (≥ 10%): hipoglicemia e edema. Reação incomum (≥ 0,1% e < 1%): anemia.
- Terapia combinada de pioglitazona mais metformina: Reação comum (≥ 1% e < 10%): anemia e edema
- Reações adversas observadas em todos os estudos clínicos: Frequência desconhecida: redução dos valores de hematócrito e hemoglobina, aumento dos níveis de transaminases séricas, redução dos valores médios de bilirrubina, redução dos valores de AST (aspartato-amino transferase), redução da fosfatase alcalina e gama GT e aumento nos níveis de CPK (creatinina fosfoquinase). Reações detectadas durante a comercialização: Frequência desconhecida: edema macular diabético e diminuição da acuidade visual.
Em casos de eventos adversos, notifique ao Sistema de Notificações em Vigilância Sanitária – NOTIVISA, disponível em www.anvisa.gov.br/hotsite/notivisa/index.htm, ou para a Vigilância Sanitária Estadual ou Municipal.
Uso em pacientes com insuficiência renal grave: a meia-vida de eliminação da pioglitazona, M-III e M-IV permanece inalterada em pacientes com disfunção renal moderada (depuração de creatinina de 30 a 60 mL/min) a grave (depuração de creatinina <30 mL/min) quando comparada a indivíduos normais. Nenhum ajuste de dose é recomendado a pacientes com disfunção renal (ver “8. Posologia e Modo de Usar”). Uso em pacientes com insuficiência hepática grave: comparados com controles normais, indivíduos com disfunção hepática (Child-Pugh grau B/C) têm uma redução de aproximadamente 45% nas concentrações de pico médias e totais da pioglitazona, mas sem alteração dos valores de ASC médios. Terapia com Stanglit não deve ser iniciada se o paciente apresentar evidência clínica de doença hepática ativa ou níveis de transaminase sérica acima de 2,5 vezes o limite superior da normalidade (ver “5. Advertências e Precauções”). Uso em idosos: em indivíduos idosos saudáveis, as concentrações séricas de pico e totais de pioglitazona não são significativamente diferentes, mas os valores de ASC e os valores de meia-vida terminal são ligeiramente maiores em relação a indivíduos mais jovens. Estas alterações não foram de uma magnitude que poderia ser considerada clinicamente relevante. Aproximadamente 500 pacientes que participaram em um estudo placebo-controlado tinham 65 anos ou mais. Nenhuma diferença significativa na segurança ou eficácia foi observada entre estes pacientes e pacientes mais jovens. Uso pediátrico: não há dados de farmacocinética disponíveis em população pediátrica. A segurança e eficácia da pioglitazona não foram estabelecidas para pacientes pediátricos, consequentemente, o uso de pioglitazona em pacientes com idade inferior a 18 anos não é recomendado. Mulheres grávidas: Categoria de risco na gravidez: C. Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
A pioglitazona não foi teratogênica em ratos para doses orais até 80 mg ou em coelhos recebendo até 160 mg/kg durante a organogênese (aproximadamente 17 e 40 vezes a dose oral máxima em mg/m2 recomendada para humanos, respectivamente). Parto demorado e embriotoxicidade foram observados em ratos em doses orais > 40 mg/kg/dia (aproximadamente 10 vezes a dose oral máxima em mg/m2 recomendada para humanos). Nenhuma toxicidade funcional ou comportamental foi observada na prole de ratos. Embriotoxicidade foi observada em coelhos para uma dose oral de 160 mg/kg (aproximadamente 40 vezes a dose oral máxima em mg/m2 recomendada para humanos). Atraso de desenvolvimento pós-natal atribuído ao decréscimo de peso corporal foi observado na prole de ratos para doses orais > 10 mg/kg durante os períodos de final da gestação e lactação (aproximadamente 2 vezes a dose oral máxima em mg/m2 recomendada para humanos). Não existem estudos adequados e bem controlados em mulheres grávidas. Stanglit deverá ser usado durante a gravidez somente se os potenciais benefícios justificarem o risco potencial para o feto. Considerando que as informações atuais sugerem fortemente que níveis anormais de glicose sanguínea durante a gestação estão associados com alta incidência de anomalias congênitas, bem como com o aumento da morbidade e mortalidade neonatais, a maioria dos especialistas recomenda o uso da insulina durante a gestação para manter os níveis de glicose sanguínea o mais próximo possível da normalidade. Lactação: pioglitazona é secretada no leite de ratas durante o período de lactação. Não se sabe se a pioglitazona é secretada no leite humano. Devido ao fato de muitos fármacos serem excretados no leite humano, a pioglitazona não deve ser administrada em mulheres durante o período de amamentação. Sexo: os valores médios de Cmáx e ASC estavam aumentados de 20% a 60% no sexo feminino. Como monoterapia e em combinação com sulfonilureias, metformina ou insulina, Stanglit melhora o controle glicêmico no sexo masculino e feminino. Em estudos clínicos controlados, diminuições da HbA1c em relação aos valores basais, geralmente foram maiores para o sexo feminino do que para o masculino (diferença média na HbA1c de 0,5%). Uma vez que o tratamento deve ser individualizado para cada paciente alcançar o controle glicêmico, não se recomenda ajuste de dose baseado somente no sexo. Etnia: não há dados de farmacocinética disponíveis para os vários grupos étnicos.
Insuficiência cardíaca congestiva: as tiazolidinedionas, incluindo Stanglit (cloridrato de pioglitazona), causam ou exacerbam a insuficiência cardíaca congestiva em alguns pacientes. Depois do início do tratamento e depois do aumento das doses, observou-se atentamente pacientes com sinais e sintomas de insuficiência cardíaca (incluindo excessivo e rápido aumento de peso, dispneia e/ou edema. Se estes sinais e sintomas se desenvolverem, a insuficiência cardíaca deverá ser controlada de acordo com os cuidados padrão. Além disso, deverá ser considerada a descontinuação ou redução da dose de Stanglit. Stanglit não é recomendado para pacientes com sintomas de insuficiência cardíaca. É contraindicado a iniciação do medicamento em pacientes com insuficiência cardíaca estabelecidos nas classes III ou IV do New York Heart Association (NYHA) – (ver “4. Contraindicações”). Diabetes tipo II e Insuficiência Cardíaca Congestiva (disfunção sistólica): foram executados estudos de segurança de 24 semanas pós-comercialização, comparando pioglitazona (n= 262) a gliburida (n= 256) em pacientes com diabetes não controlada (média HbA1c 8,8% ), com insuficiência cardíaca classes II e III do NYHA e fração de ejeção inferior a 40% (média FE 30% no início do estudo). Durante o estudo, a hospitalização por insuficiência cardíaca congestiva (I50.0) foi relatada em 9,9 % dos pacientes sob efeito da pioglitazona comparados com 4,7% dos pacientes sob efeito de gliburida com diferença no tratamento observado por 6 semanas. Este evento adverso associado a pioglitazona foi marcado em maior quantidade em pacientes usuários de insulina no início do estudo e em pacientes com mais de 64 anos de idade. Nenhuma diferença na mortalidade cardiovascular foi observada entre os grupos do tratamento. O cloridrato de pioglitazona deve ser iniciado com a menor dose aprovada que é prescrita para pacientes com diabetes tipo II e insuficiência cardíaca sistólica (classe I e II do NYHA). Se um aumento subsequente da dose for necessário, deve ser aumentada gradualmente somente em alguns meses de tratamento, com monitoração cuidadosa para o ganho de peso, edema, ou sinais e sintomas de exacerbação do quadro de insuficiência cardíaca congestiva (ICC). Geral: o cloridrato de pioglitazona exerce seu efeito anti-hiperglicêmico somente na presença de insulina, portanto não deve ser utilizado em pacientes portadores de diabetes tipo 1 ou para o tratamento de cetoacidose diabética. Hipoglicemia: pacientes recebendo cloridrato de pioglitazona em combinação com insulina ou agentes hipoglicemiantes orais correm risco de apresentar hipoglicemia, podendo ser necessária a redução do agente concomitante.
Ovulação: em pacientes que estejam em período anovulatório pré- menopausa por resistência insulínica, o tratamento com tiazolidinedionas, incluindo pioglitazona, pode resultar em reinício da ovulação. Como consequência da melhora da sensibilidade à insulina, estas pacientes podem apresentar risco de gravidez se contracepção adequada não for usada. Hematológicas: a pioglitazona pode causar decréscimos na hemoglobina e hematócrito. Em todos os estudos clínicos, os valores médios de hemoglobina caíram cerca de 2% a 4% nos pacientes tratados com cloridrato de pioglitazona. Estas alterações ocorreram primariamente dentro das primeiras 4 a 12 semanas de tratamento e permaneceram relativamente constantes. Estas alterações podem estar relacionadas com o aumento de volume plasmático e não foram associadas com nenhum efeito hematológico clinicamente significante. Edema: pioglitazona deve ser usada com cuidado em pacientes com edema. Em todos os estudos americanos, edema foi relatado mais frequentemente nos pacientes tratados com pioglitazona do que nos tratados com placebo e parece ser dose-dependente (ver “9. Reações Adversas”). No período de póscomercialização, houve relatos de início ou piora de edema. Uma vez que tiazolidinedionas, incluindo pioglitazona, podem causar retenção de fluído, que pode agravar ou conduzir a insuficiência cardíaca congestiva, pioglitazona deve ser usada com cautela por pacientes sob risco de insuficiência cardíaca. Os pacientes deverão ser monitorados por causa dos sinais e sintomas de insuficiência cardíaca. Edema Macular: na experiência pós-comercialização, o edema macular foi relatado por pacientes diabéticos que tomaram pioglitazona ou um outro medicamento da classe das tiazolidinedionas. Alguns pacientes apresentaram visão borrada ou redução da acuidade visual, porém alguns pacientes parecem ter sido diagnosticados no exame de rotina oftalmológica. Outros pacientes tiveram edema periférico no momento em que o edema macular foi diagnosticado. Alguns pacientes tiveram a melhoria do seu edema macular após a descontinuação de medicamento da classe das tiazolidinedionas. De qualquer forma, é desconhecido se existe relação causal entre pioglitazona e edema macular. Pacientes com diabetes devem fazer exames regulares dos olhos com o seu oftamologista. Adicionalmente, qualquer diabético que relatar algum tipo de sintoma visual deverá recorrer prontamente ao oftalmologista, independentemente de outros sintomas físicos ou do paciente estar ingerindo qualquer medicação (ver “9. Reações Adversas”). Insuficiência cardíaca e outros eventos cardíacos: nos estudos clínicos americanos controlados com placebo, que excluíram pacientes em classes III e IV da New York Heart Association (NYHA), a incidência de eventos adversos cardíacos graves relacionados à expansão de volume não foi aumentada nos pacientes tratados com pioglitazona em monoterapia ou em combinação com sulfonilureias ou metformina, em comparação com os pacientes tratados com placebo. Nos estudos de combinação com insulina, um pequeno número de pacientes com antecedentes pessoais de doença cardíaca pré-existente desenvolveu insuficiência cardíaca congestiva quando tratado com pioglitazona em combinação com insulina. Pacientes em classes III e IV da NYHA não foram estudados nos estudos clínicos da pioglitazona. Portanto, o cloridrato de pioglitazona não é indicado para pacientes em classes III e IV da NYHA (New York Heart Association). Na experiência pós-comercialização com pioglitazona, foram relatados casos de insuficiência cardíaca congestiva em pacientes tanto com quanto sem doença cardíaca prévia conhecida. Stanglit, semelhante a outras tiazolidinedionas, pode causar retenção de fluído quando usado sozinho ou em combinação com outros agentes antidiabéticos, incluindo a insulina. A retenção de fluído pode levar ao exacerbamento da insuficiência cardíaca. Se estes sinais e sintomas evoluírem, a insuficiência cardíaca deve ser controlada de acordo com os padrões de cuidados atuais. Além disso, deve ser considerada a descontinuação ou redução da dose de pioglitazona. Pacientes com insuficiência cardíaca classes III e IV da NYHA não foram estudados durante a pré-aprovação clínica do estudo e o medicamento não é recomendado para estes pacientes (ver “4. Contraindicações”). O uso de Stanglit deverá ser descontinuado se promover a deterioração do estado cardíaco. Estudo Prospectivo de Pioglitazona em Eventos (PROactive Study): No estudo PROactive, 5.238 pacientes com diabetes tipo II e com história anterior de doença macrovascular foram tratados com cloridrato de pioglitazona (n = 2605), dosagem com até 45 mg uma vez ao dia, ou com placebo (n = 2633) (ver “9. Reações Adversas”). A porcentagem de pacientes que tiveram eventos sérios de insuficiência cardíaca foi maior para pacientes tratados com cloridrato de pioglitazona (5,7%, n = 149) do que para pacientes tratados com placebo (4,1%, n = 108). A incidência de morte subsequente ao relatório de insuficiência cardíaca séria foi de 1,5% (n = 40) nos pacientes tratados com pioglitazona e 1,4% (n = 37) nos pacientes tratados com placebo. Nos pacientes tratados com esquemas terapêuticos contendo insulina desde o início do tratamento, a incidência de insuficiência cardíaca séria foi 6,3% (n = 54/864) com pioglitazona e 5,2% (n = 47/896) com placebo. Para aqueles pacientes tratados com sulfonilureia desde o início do estudo, a incidência de insuficiência cardíaca séria foi 5,8% (n = 94/1624) com pioglitazona e 4,4% (n = 71/1626) com placebo. Em outro estudo clínico americano de 16 semanas, duplo-cego, controlado com placebo, envolvendo 566 pacientes com diabetes tipo II, o tratamento com pioglitazona nas doses de 15 mg e 30 mg, em combinação com insulina foi comparado com o tratamento com insulina isoladamente. Este estudo incluiu pacientes com diabetes de longa duração e alta prevalência de condições médicas pré-existentes como: hipertensão arterial (57,2%), neuropatia periférica (22,6%), doença coronariana (19,6%), retinopatia (13,1%), infarto do miocárdio (8,8%), doença vascular (6,4%), angina pectoris (4,4%), acidente vascular cerebral e/ou ataque isquêmico transitório (4,1%) e insuficiência cardíaca congestiva (2,3%). Neste estudo, 2 dos 191 pacientes que receberam 15 mg de pioglitazona mais insulina (1,1%), e 2 dos 188 pacientes que receberam 30 mg de pioglitazona mais insulina (1,1%), apresentaram insuficiência cardíaca congestiva em comparação com nenhum dos 187 pacientes tratados com insulina isoladamente. Esses quatro pacientes apresentavam antecedentes pessoais de condições cardiovasculares incluindo doença coronariana, procedimentos prévios de revascularização miocárdica e infarto do miocárdio. Em um estudo de 24 semanas dose-controlado no qual a pioglitazona foi coadministrada com insulina, 0,3% dos pacientes (1/345) com 30 mg e 0,9% (3/345) dos pacientes com 45 mg relataram insuficiência cardíaca congestiva como evento adverso sério. A análise dos dados deste estudo não identificou fatores específicos de previsão de risco aumentado de insuficiência cardíaca congestiva no tratamento combinado com insulina. Ganho de peso: foi observado ganho de peso relacionado à dose com pioglitazona isoladamente ou em combinação com outros antidiabéticos orais. O mecanismo do ganho de peso não está estabelecido, mas provavelmente envolve combinação de retenção de líquidos e acúmulo de gordura. Efeitos hepáticos: um outro fármaco da classe das tiazolidineodionas, troglitazona, foi associado com hepatotoxicidade idiossincrática e casos muito raros de insuficiência hepática, transplantes de fígado e morte foram registrados durante o uso pós-comercialização. Em estudos clínicos controlados de pré-comercialização em pacientes com diabetes tipo II, a troglitazona foi mais frequentemente associada com elevações significativas de enzimas hepáticas (ALT - alanina-aminotransferase > 3 vezes o limite superior de normalidade) comparada com placebo, e casos muito raros de icterícia reversível foram registrados. Em estudos clínicos em todo o mundo, mais de 4500 indivíduos foram tratados com cloridrato de pioglitazona. Em estudos clínicos nos Estados Unidos, mais de 2500 pacientes com diabetes tipo II receberam cloridrato de pioglitazona. Não houve nenhuma evidência de hepatotoxicidade induzida pelo fármaco ou elevação dos níveis de ALT. Durante estudos clínicos controlados com placebo nos EUA, um total de 4 de 1526 (0,26%) dos pacientes tratados com cloridrato de pioglitazona e 2 de 793 (0,25%) dos pacientes tratados com placebo tiveram valores de ALT maiores ou iguais a 3 vezes o limite superior da normalidade. As elevações de ALT em pacientes tratados com cloridrato de pioglitazona foram reversíveis e não foram relacionadas com a terapia com pioglitazona. Embora os dados clínicos disponíveis não mostrem nenhuma evidência de hepatotoxicidade ou elevações de ALT induzidas por pioglitazona, a mesma está estruturalmente relacionada com a troglitazona, a qual tem sido associada com hepatotoxicidade idiossincrática e raros casos de insuficiência hepática, transplantes de fígado e morte. Até que dados adicionais mais amplos sobre segurança da pioglitazona, provenientes de estudos clínicos controlados de longa duração e de farmacovigilância pós-comercialização estejam disponíveis, recomenda-se que pacientes tratados com cloridrato de pioglitazona sejam submetidos a monitorações periódicas de enzimas hepáticas. Os níveis de ALT devem ser avaliados antes do início do tratamento com cloridrato de pioglitazona em todos os pacientes, a cada 2 meses durante o primeiro ano de terapia e periodicamente após isto. Testes de função hepática também devem ser realizados se aparecerem sintomas sugestivos de disfunção hepática (náuseas, vômitos, dor abdominal, fadiga, anorexia, urina escura). A decisão de se continuar o tratamento com cloridrato de pioglitazona deve ser guiada pelo julgamento clínico dependendo das avaliações laboratoriais. Se for observada icterícia, o tratamento deve ser descontinuado. O tratamento com cloridrato de pioglitazona não deve ser iniciado se o paciente apresentar evidência clínica de doença hepática ativa ou níveis de ALT 2,5 vezes acima dos limites da normalidade. Pacientes com enzimas hepáticas moderadamente elevadas (níveis de ALT entre 1 e 2,5 vezes o limite superior da normalidade), antes do início ou a qualquer momento durante o tratamento com cloridrato de pioglitazona, devem ser avaliados para se determinar a causa desta elevação. O início ou a continuidade do tratamento com cloridrato de pioglitazona em pacientes com elevação moderada de enzimas hepáticas devem ser realizados com cautela e devem incluir um acompanhamento clínico apropriado, o qual pode incluir uma monitoração mais frequente de enzimas hepáticas. Se os níveis de ALT estiverem >2,5 vezes o limite superior da normalidade, testes de função hepática devem ser realizados com mais frequência até que seus níveis retornem ao normal ou a valores do pré-tratamento. Se os níveis de ALT excederem 3 vezes o limite superior da normalidade, o exame deve ser repetido assim que possível. Se os níveis de ALT permanecerem 3 vezes acima do normal ou se o paciente estiver ictérico, o tratamento com cloridrato de pioglitazona deve ser descontinuado. Não existem dados disponíveis para se avaliar a segurança da pioglitazona em pacientes que apresentaram anormalidades hepáticas, disfunção hepática ou icterícia durante o uso de troglitazona. A pioglitazona não deve ser usada em pacientes que apresentaram icterícia durante o uso de troglitazona. Para pacientes com os níveis das enzimas hepáticas normais que mudarão de troglitazona para pioglitazona, uma semana de intervalo é recomendada antes do início da terapia com pioglitazona. Fraturas: Em um ensaio randomizado (PROactive) em pacientes com diabetes tipo II (duração média do diabetes - 9,5 anos), o aumento da incidência de fratura óssea foi notada em mulheres que tomaram pioglitazona. Durante uma média de 34,5 meses de acompanhamento, a incidência de osso fraturado em mulheres foi 5,1% (44/870) para pioglitazona contra 2,5% (23/905) para placebo. Esta diferença foi notada depois do primeiro ano de tratamento e permanecida durante o curso do estudo. A maioria das fraturas observadas em mulheres eram não vertebrais incluindo membro inferior e membro superior distal. Nenhum aumento das taxas de fratura foi observado em homens no tratamento com pioglitazona 1,7% (30/1735) contra placebo 2,1% (37/1728). O risco de fraturas deve ser considerado nos cuidados com os pacientes, especialmente em mulheres tratadas com pioglitazona e deve ser dada atenção à avaliação e manutenção da saúde do osso de acordo com os padrões de cuidado atuais. Tumores na bexiga: foram observados tumores na bexiga de ratos machos em estudo de carcinogenicidade de dois anos. Em dois estudos clínicos de três anos nos quais pioglitazona foi comparado a placebo ou gliburida, houve 16/3656 (0,44%) relatos de câncer na bexiga em pacientes administrando pioglitazona e 5/3679 (0,14%) em pacientes não administrando pioglitazona. Após a exclusão de pacientes cuja exposição ao medicamento em estudo foi inferior a um ano no momento do diagnóstico de câncer de bexiga, houve 6 (0,16%) casos relatados com o uso de pioglitazona e 2 casos (0,05%) com placebo. A análise interina de cinco anos de um estudo de coorte observacional em andamento com duração de 10 anos demonstrou um aumento não significante no risco de câncer de bexiga em pessoas expostas a pioglitazona, quando comparado com pessoas nunca expostas a pioglitazona (HR 1,2 [IC 95% 0,9- 1,5]). Quando comparada com a ausência de exposição, a duração do tratamento com pioglitazona superior a 12 meses foi associada a um aumento no risco (HR 1,4 [IC 95% 0,9-2,1]), atingindo significância estatística com uso de pioglitazona superior a 24 meses (HR 1,4 [IC 95% 1,03-2,0]). Resultados interinos deste estudo sugerem que a administração de pioglitazona por um período superior a 12 meses elevou o risco relativo de desenvolvimento de câncer de bexiga em qualquer ano em 40%, resultando em um aumento absoluto de três casos em 10.000 (de aproximadamente 7 em 10.000 sem pioglitazona a aproximadamente 10 em 10.000 com pioglitazona). Os dados são insuficientes para determinar se pioglitazona pode ser considerada um promotor de tumores no caso de bexiga. Consequentemente, a pioglitazona não deve ser utilizada em pacientes com câncer de bexiga ativo e os benefícios do controle glicêmico versus riscos não conhecidos da recorrência de câncer com uso de pioglitazona devem ser considerados em pacientes com histórico de câncer de bexiga. Exames laboratoriais: medidas de glicemia de jejum e hemoglobina glicosilada devem ser realizadas periodicamente para monitorar o controle glicêmico e a resposta terapêutica ao cloridrato de pioglitazona. A monitoração das enzimas hepáticas é recomendada antes de iniciar o tratamento com pioglitazona em todos os pacientes, e depois, periodicamente (ver “5. Advertências e Precauções - geral, efeito hepático” e “9. Reações adversas - Transaminases séricas”). Carcinogênese, mutagênese e comprometimento da fertilidade: um estudo de dois anos em carcinogenicidade foi conduzido em ratos machos e fêmeas com doses orais de até 63 mg/kg (aproximadamente 14 vezes o valor da dose oral máxima de 45 mg/m2 recomendada para humanos). Tumores induzidos pelo fármaco não foram observados em nenhum órgão, exceto na bexiga. Neoplasias benignas e/ou malignas em células transicionais foram observadas em ratos machos em doses de 4 mg/kg/dia ou mais (aproximadamente igual à dose oral máxima em mg/m2 recomendada para humanos). Um estudo de dois anos em carcinogenicidade foi conduzido em camundongos machos e fêmeas com doses orais de 100 mg/kg/dia (aproximadamente 11 vezes a dose oral máxima em mg/m2 recomendada para humanos). Tumores induzidos pelo fármaco não foram observados em nenhum órgão. Tumores do trato urinário foram relatados em roedores que ingeriram drogas experimentais com dupla atividade PPAR α/γ; entretanto, a pioglitazona é um agonista seletivo para PPARγ. Durante a avaliação prospectiva de citologia urinária, envolvendo mais de 1800 pacientes recebendo pioglitazona em estudos clínicos de até um ano de duração, não foi identificado nenhum caso novo de tumor de bexiga. Ocasionalmente, resultados anormais de citologia urinária indicando possível malignidade foram observados tanto com pacientes tratados com cloridrato de pioglitazona (0,72%) como com placebo (0,88%). O cloridrato de pioglitazona não foi mutagênico em uma bateria de estudos de toxicologia genética, incluindo o teste bacteriano de Ames, um teste de ativação mutagênica de células de mamíferos (CHO/HPTR e AS52/XPRT), um teste citogenético in vitro usando células CHL, um teste de síntese de DNA não programado e um teste in vivo de micronúcleos. Nenhum evento adverso sobre fertilidade foi observado em ratos machos e fêmeas para doses orais de até 40 mg/kg/dia de cloridrato de pioglitazona antes e durante o acasalamento e gestação (aproximadamente 9 vezes a dose oral máxima em mg/m2 recomendada para humanos). Toxicologia animal: foi observado aumento do coração em camundongos (100 mg/kg), em ratos (>4mg/kg) e em cães (3 mg/kg) tratados oralmente com cloridrato de pioglitazona (aproximadamente 11, 1, e 2 vezes a dose oral máxima em mg/m2 recomendada para humanos, respectivamente). Em um estudo de um ano em ratos, morte precoce relacionada com o fármaco devido a aparente disfunção cardíaca ocorreu na dose oral de 160 mg/kg/dia (35 vezes a dose oral máxima em mg/m2 recomendada para humanos). Aumento do coração foi observado em um estudo de 13 semanas em macacos recebendo doses orais > 8,9 mg/kg (aproximadamente 4 vezes a dose oral máxima em mg/m2 recomendada para humanos), mas não em um estudo de 52 semanas com doses orais de até 32 mg/kg (aproximadamente 13 vezes a dose oral máxima em mg/m2 recomendada para humanos).
COMPOSIÇÃO Cada comprimido contém 16,53 mg de cloridrato de pioglitazona (equivalente a 15 mg de pioglitazona base); 33,05 mg de cloridrato de pioglitazona (equivalente a 30 mg de pioglitazona base) ou 49,59 mg de cloridrato de pioglitazona (equivalente a 45 mg de pioglitazona base) Excipientes: hiprolose, lactose monoidratada, celulose microcristalina, corante laca azul brilhante, amarelo quinolina, croscarmelose sódica e estearato de magnésio INFORMAÇÕES AO PACIENTE 1
Durante os estudos clínicos, um caso de superdosagem foi registrado. Um paciente do sexo masculino ingeriu 120 mg/dia durante 4 dias e após isto, 180 mg/dia durante 7 dias. O paciente negou qualquer sintoma clínico durante este período. Em caso de superdosagem, deve ser iniciado tratamento de suporte adequado, de acordo com os sintomas e sinais clínicos do paciente. Em caso de intoxicação ligue para 0800 722 6001, se você precisar de mais orientações.
Um inibidor de CYP2C8 (como genfibrozila) pode elevar a ASC de pioglitazona e um indutor de CYP2C8 (como rifampicina) pode reduzir a ASC de pioglitazona.
Foi relatado que a coadministração de pioglitazona com genfibrozila resulta em um aumento de três vezes na ASC de pioglitazona. Uma vez que a pioglitazona apresenta um potencial para efeitos adversos relacionados com a dose, uma diminuição da dose de pioglitazona pode ser necessária quando genfibrozila for administrado concomitantemente.
Foi relatado que a coadministração de pioglitazona com rifampicina resulta em uma diminuição de 54% na ASC de pioglitazona. Pode ser necessário aumentar a dose de pioglitazona em função da resposta clínica quando a rifampicina é administrada concomitantemente.
Estudos de interação demonstraram que a pioglitazona não afeta a farmacocinética ou farmacodinâmica da digoxina, varfarina, femprocumona ou metformina, e em coadministração com sulfonilureias não parece afetar a farmacocinética da sulfonilureia. Estudos em humanos não mostram indução dos principais citocromos induzidos P450, 1A, 2C8/9 e 3A4. Estudos in vitro não demonstraram inibição de qualquer subtipo dos citocromos P450; interações com substâncias metabolizadas por estas enzimas, por exemplo, contraceptivos orais, ciclosporina, bloqueadores do canal de cálcio e os inibidores de reductase HMGCoA não são esperados. Hipoglicemia pode ocorrer quando pioglitazona é administrada com sulfonilureia ou insulina
Os pacientes que receberam pioglitazona em combinação com insulina ou outros medicamentos antidiabéticos (particulamermente insulinas secretagogos como sulfonilureias) podem correr risco de desenvolverem hipoglicemia. A redução da dose da medicação antidiabética concomitante pode ser necessária para reduzir o risco de hipoglicemia.
Não há relatos até o momento.
Resultados da eficácia
Monoterapia
Três estudos randomizados, duplo-cegos, placebo-controlados com durações de 16 a 26 semanas foram conduzidos para avaliar o uso de pioglitazona em monoterapia em pacientes com diabetes tipo 2. Estes estudos avaliaram pioglitazona em doses de até 45 mg ou placebo uma vez por dia em um total de 865 pacientes.
Estudo de variação de dose (Estudo PNFP-001)
Em um estudo de monoterapia com variação de dose, de 26 semanas, 408 pacientes com diabetes tipo II foram randomizados para receber 7,5 mg, 15 mg, 30 mg ou 45 mg de pioglitazona ou placebo uma vez ao dia. A terapia com qualquer agente antidiabético anterior foi interrompida 8 semanas antes do período duplo-cego. O tratamento com 15 mg, 30 mg e 45 mg de pioglitazona produziu melhorias estatisticamente significativas na HbA1c e na glicemia em jejum no desfecho “endpoint” em comparação com placebo (vide Figura 1, Tabela 1). Figura 1 mostra o decurso de tempo para alterações na HbA1c neste estudo de 26 semanas.
Figura 1: Alteração média do valor basal para HbA1c em um estudo de variação de dose placebo-controlado de 26 semanas (valores observados) – Estudo PNFP-001


*Ajustado pela linha basal, centro-agrupado e centro-agrupado por interação do tratamento.
†p ≤ 0,05 vs. placebo
Estudo de titulação de dose (Estudo PNFP-012)
Em um estudo de monoterapia controlado por placebo, por 24 semanas, 260 pacientes com diabetes tipo II foram randomizados para um dos dois grupos de tratamento com titulação forçada de pioglitazona ou um grupo de titulação simulada com placebo. O tratamento com qualquer agente antidiabético anterior foi interrompido 6 semanas antes do período do duplo-cego. Em um dos grupos de tratamento com pioglitazona, os pacientes receberam uma dose inicial de 7,5 mg uma vez por dia. Após quatro semanas, a dose foi aumentada para 15 mg uma vez por dia e, após mais quatro semanas, a dose foi aumentada para 30 mg uma vez por dia durante o resto do ensaio (16 semanas). No segundo grupo de tratamento com pioglitazona, os pacientes receberam uma dose inicial de 15 mg uma vez por dia e foram titulados a 30 mg uma vez por dia e 45 mg uma vez por dia de uma forma semelhante.
O tratamento com pioglitazona, como descrito, produziu melhoras estatisticamente significativas na HbA1c e FPG no desfecho “endpoint”, em comparação com placebo (vide Tabela 2).

*Ajustado pela linha basal, centro-agrupado e centro-agrupado por interação do tratamento.
**Dose final em titulação forçada
†p ≤ 0,05 vs. placebo
Estudo de monoterapia de 16 semanas (Estudo PNFP-026)
Num estudo de monoterapia de 16 semanas, 197 pacientes com diabetes tipo II foram randomizados para o tratamento com 30 mg de pioglitazona ou placebo uma vez ao dia. O tratamento com qualquer agente antidiabético anterior foi interrompido 6 semanas antes do período do duplo-cego. O tratamento com 30 mg de pioglitazona produziu melhorias estatisticamente significativas na HbA1c e FPG no desfecho “endpoint”, em comparação com placebo (Tabela 3).
| Tabela 3: Parâmetros glicêmicos em 16 semanas de estudo de monoterapia placebo-controlado (Estudo PNFP-012) | ||
| Placebo | Pioglitazona 30mg/dia | |
| População total | ||
| HbA1C (%) | N = 93 | N = 100 |
| Basal (média) | 10,3 | 10,5 |
| Mudança do basal (média ajustada*) | 0,8 | -0,6 |
| Diferença do placebo (média ajustada*) Intervalo de confiança 95% | -1,4† (-1,8, -0,9) | |
| Glicemia de jejum (mg/dL) | N = 91 | N = 99 |
| Basal (média) | 270 | 273 |
| Mudança do basal (média ajustada*) | 8 | -50 |
| Diferença do placebo (média ajustada*) Intervalo de confiança 95% | -58† (-77, -38) | |
*Ajustado pela linha basal, centro-agrupado e centro-agrupado por interação do tratamento.
†p ≤ 0,05 vs. Placebo
Terapia Combinada
Três estudos clínicos de 16 semanas, duplo-cegos randomizados, placebo-controlados foram realizados para avaliar os efeitos da pioglitazona (15 mg e/ou 30 mg) sobre o controle glicêmico em pacientes com diabetes tipo II que estavam sob controle inadequado (HbA1c ≥ 8%), apesar da terapia vigente com uma sulfonilureia, metformina ou insulina. Além disso, três estudos clínicos de 24 semanas duplo-cegos randomizados, foram realizados para avaliar os efeitos da pioglitazona 30 mg versus pioglitazona 45 mg sobre o controle glicêmico em pacientes com diabetes tipo II que estavam sob controle inadequado (HbA1 ≥ 8%), apesar da terapia vigente com uma sulfonilureia, metformina ou insulina. O tratamento anterior do diabetes pode ter sido monoterapia ou terapia combinada.
Estudos de associação a sulfonilureias
Dois estudos clínicos foram conduzidos com pioglitazona em combinação com uma sulfonilureia. Em ambos os estudos, foram incluídos pacientes com diabetes tipo II em qualquer dose de uma sulfonilureia, quer isoladamente ou em combinação com outro agente antidiabético.
Todos os outros agentes antidiabéticos foram retirados pelo menos três semanas antes do início do tratamento do estudo.
Estudo de 16 semanas com associação a sulfonilureia (Estudo PNFP-010)
No primeiro estudo, 560 pacientes foram distribuídos aleatoriamente para receber 15 mg ou 30 mg de pioglitazona ou placebo, uma vez ao dia, durante 16 semanas, em adição ao seu regime atual de sulfonilureia. O tratamento com pioglitazona em associação à sulfonilureia produziu melhoras estatisticamente significativas na HbA1c e FPG no desfecho “endpoint” em comparação com placebo em associação a sulfonilureias (Tabela 4).
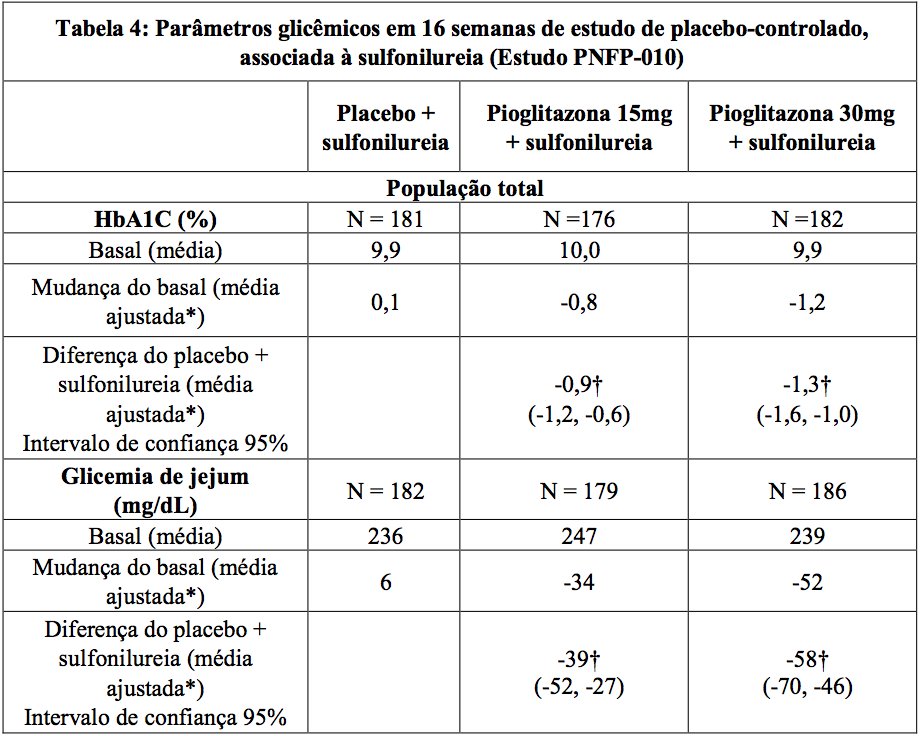
*Ajustado pela linha basal, centro-agrupado e centro-agrupado por interação do tratamento.
†p ≤ 0,05 vs. placebo + sulfonilureia
Estudo de 24 semanas com associação à sulfonilureia (Estudo PNFP-341)
No segundo estudo, 702 pacientes foram randomizados para receber 30 mg ou 45 mg de pioglitazona uma vez por dia, durante 24 semanas, além de seu regime vigente de sulfonilureia. A redução média de HbA1c em relação ao valor basal na 24a semana foi de 1,6% para a dose de 30 mg e 1,7% para a dose de 45 mg (vide Tabela 5). A redução média de FPG em relação ao valor basal na 24a semana foi de 52 mg/dL para o 30 mg de dose e 56 mg/dL para a dose de 45 mg.
O efeito terapêutico de pioglitazona em combinação com a sulfonilureia foi observado em pacientes, independentemente da dose de sulfonilureia.
| Tabela 5: Parâmetros glicêmicos em 24 semanas de estudo de placebo-controlado, associada à sulfonilureia (Estudo PNFP-341) | ||
| Pioglitazona 30mg + sulfonilureia | Pioglitazona 45mg + sulfonilureia | |
| População total | ||
| HbA1C (%) | N = 340 | N = 332 |
| Basal (média) | 9,8 | 9,9 |
| Mudança do basal (média ajustada*) | -1,6 | -1,7 |
| Diferença do pioglitazona 30mg + sulfonilureia (média ajustada*) 95% IC | -0,1 (-0,4, 0,1) | |
| Glicemia de jejum (mg/dL) | N = 338 | N = 329 |
| Basal (média) | 214 | 217 |
| Mudança do basal (média ajustada*) | -52 | -56 |
| Diferença do pioglitazona 30mg + sulfonilureia (média ajustada*) 95% IC | -5 (-12, 3) | |
95% IC = Intervalo de confiança 95%
*Ajustado pela linha basal, centro-agrupado e centro-agrupado por interação do tratamento.
Estudos de associação à metformina
Dois estudos clínicos foram conduzidos com pioglitazona em combinação com metformina. Ambos os ensaios incluíram pacientes com diabetes tipo II em qualquer dose de metformina, quer isoladamente ou em combinação com outro agente antidiabético. Todos os outros agentes antidiabéticos foram retirados pelo menos três semanas antes do início do tratamento do estudo.
Estudo de 16 semanas com associação à metformina (Estudo PNFP-027)
No primeiro estudo, 328 pacientes foram randomizados para receber 30 mg de pioglitazona ou placebo uma vez ao dia, durante 16 semanas, além do regime de metformina. O tratamento com pioglitazona em associação à metformina produziu melhoras estatisticamente significativas na HbA1c e FPG no desfecho “endpoint” em comparação ao tratamento com placebo associado à metformina (vide Tabela 6).
| Tabela 6: Parâmetros glicêmicos em 16 semanas de estudo de placebo-controlado, associada à metformina (Estudo PNFP-027) | ||
| Placebo + metformina | Pioglitazona 30mg + metformina | |
| População total | ||
| HbA1C (%) | N = 153 | 161 |
| Basal (média) | 9,8 | 9,9 |
| Mudança do basal (média ajustada*) | 0,2 | -0,6 |
| Diferença do placebo + metformina (média ajustada*) Intervalo de Confiança 95% | -0,8† (-1,2, -0,5) | |
| Glicemia de jejum (mg/dL) | N = 157 | N = 165 |
| Basal (média) | 260 | 254 |
| Mudança do basal (média ajustada*) | -5 | -43 |
| Diferença do placebo + metformina (média ajustada*) Intervalo de Confiança 95% | -38† (-49, -26) | |
*Ajustado pela linha basal, centro-agrupado e centro-agrupado por interação do tratamento.
†p ≤ 0,05 vs. placebo + metformina
Estudo de 24 semanas com associação à metformina (Estudo PNFP-342)
No segundo estudo, 827 pacientes foram randomizados para receber 30 mg ou 45 mg de pioglitazona uma vez por dia, durante 24 semanas, além do regime de metformina.
A redução média de HbA1c em relação ao valor basal na 24a semana foi de 0,8% para a dose de 30 mg e 1,0% para a dose de 45 mg (vide Tabela 7). A redução média de FPG em relação ao valor basal na 24a semana foi de 38 mg/dL para a dose de 30 mg e 51 mg/dL para a dose de 45 mg.
| Tabela 7: Parâmetros glicêmicos em 24 semanas de estudo de placebo-controlado, associada à metformina (Estudo PNFP-342) | ||
| Pioglitazona 30mg + metformina | Pioglitazona 45mg + metformina | |
| População total | ||
| HbA1C (%) | N = 400 | N = 398 |
| Basal (média) | 9,9 | 9,8 |
| Mudança do basal (média ajustada*) | -0,8 | -1 |
| Diferença do pioglitazona 30mg + metformina (média ajustada*) 95% IC | -0,2 (-0,5, 0,1) | |
| Glicemia de jejum (mg/dL) | N = 398 | N = 399 |
| Basal (média) | 233 | 232 |
| Mudança do basal (média ajustada*) | -38 | -51 |
| Diferença do pioglitazona 30mg + metformina (média ajustada*) 95% IC | -12† (-21, 4) | |
95% IC = Intervalo de confiança 95%
*Ajustado pela linha basal, centro-agrupado e centro-agrupado por interação do tratamento.
† p ≤ 0,05 vs. pioglitazona 30 mg, um comprimido, diariamente + metformina
O efeito terapêutico de pioglitazona em combinação com a metformina foi observada em pacientes, independentemente da dose de metformina.
Estudos de associação à insulina
Dois estudos clínicos foram conduzidos com este produto, em combinação com a insulina. Em ambos os ensaios, foram incluídos pacientes com diabetes tipo II em tratamento com insulina, quer isoladamente ou em combinação com outro agente antidiabético. Todos os outros agentes antidiabéticos foram retirados antes do início do tratamento de estudo.
Estudo de associação à insulina (Estudo PNFP-014)
No primeiro estudo, 566 pacientes foram randomizados para receber 15 mg ou 30 mg de pioglitazona ou placebo uma vez ao dia, durante 16 semanas, além do regime de insulina. O tratamento com pioglitazona em associação à insulina produziu melhorias estatisticamente significativas na HbA1c e FPG no desfecho “endpoint” em comparação com placebo em associação à insulina (vide Tabela 8). A dose diária de insulina média no início do estudo, em cada grupo de tratamento foi de aproximadamente 70 unidades. A maioria dos pacientes (75% do total, 86% dos tratados com placebo, 77% tratados com pioglitazona 15 mg, e 61% tratados com pioglitazona 30 mg) não teve alteração em sua dose diária de insulina desde o valor basal até a última visita do estudo. A alteração média do valor basal na dose diária de insulina (incluindo pacientes sem modificações da dose de insulina) foi de -3 unidades nos pacientes tratados com pioglitazona 15 mg, -8 unidades nos pacientes tratados com pioglitazona 30 mg, e -1 unidade em pacientes tratados com placebo.

*Ajustado pela linha basal, centro-agrupado e centro-agrupado por interação do tratamento.
† p ≤ 0,05 vs. placebo + insulina
Estudo de 24 semanas com associação à insulina (Estudo PNFP-343)
No segundo estudo, 690 pacientes que recebem uma média de 60 unidades de insulina por dia foram randomizados para receber 30 mg ou 45 mg de pioglitazona uma vez por dia, durante 24 semanas, além do regime atual de insulina. A redução média de HbA1c em relação ao valor basal na 24a semana foi de 1,2% para a dose de 30 mg e 1,5% para a dose de 45 mg. A redução média de FPG em relação ao valor basal na 24a semana foi de 32 mg / dL para a dose de 30 mg e de 46 mg / dL para a dose de 45 mg (vide Tabela 9). A maioria dos pacientes (55% do total, 58% tratados com pioglitazona 30 mg, e 52% tratados com pioglitazona 45 mg) não teve alteração em sua dose diária de insulina a partir do valor basal até a última visita do estudo. A alteração média do valor basal na dose diária de insulina (incluindo pacientes sem modificações da dose de insulina) foi de -5 unidades nos pacientes tratados com pioglitazona 30 mg e -8 unidades nos pacientes tratados com pioglitazona 45 mg.
| Tabela 9: Parâmetros glicêmicos em 24 semanas de estudo de placebo-controlado, associada à insulina (Estudo PNFP-343) | ||
| Pioglitazona 30mg + insulina | Pioglitazona 45mg + insulina | |
| População total | ||
| HbA1C (%) | N = 328 | N = 328 |
| Basal (média) | 9,9 | 9,7 |
| Mudança do basal (média ajustada*) | -1,2 | -1,5 |
| Diferença do pioglitazona 30mg + insulina (média ajustada*) 95% IC | -0,3† (-0,5, -0,1) | |
| Glicemia de jejum (mg/dL) | N = 325 | N = 327 |
| Basal (média) | 202 | 199 |
| Mudança do basal (média ajustada*) | -32 | -46 |
| Diferença do pioglitazona 30mg + insulina (média ajustada*) 95% IC | -14† (-25, -3) | |
95% IC = Intervalo de confiança 95%
*Ajustado pela linha basal, centro-agrupado e centro-agrupado por interação do tratamento.
† p ≤ 0,05 vs. pioglitazona 30 mg, um comprimido, diariamente + insulina
O efeito terapêutico de pioglitazona em combinação com insulina foi observado nos pacientes, independentemente da dose de insulina.
Em vários ensaios clínicos, incluindo ensaios comparativos duplo-cego, em pacientes com diabetes mellitus tipo II dando 15 mg, 30 mg ou 45 mg de pioglitazona uma vez por dia, a taxa de melhoria ("melhora moderada" ou avaliações melhores) em 821 pacientes, que foram incluídos na análise da classificação global de melhoria na glicose no sangue, foi de 50,8% (417/821 pacientes).
Nos estudos de administração a longo prazo (28-48 semanas ou mais), foi alcançado um controle estável da glicose no sangue, com a redução da glicemia de jejum e HbA1c sendo mantida, sem diminuição do efeito terapêutico.
Os resultados de ensaios comparativos duplo-cegos em pacientes com efeitos terapêuticos satisfatórios são os seguintes:
- - Diabetes mellitus tipo II tratados com somente dieta e/ou terapia exercício: Como resultado do tratamento com dose de 30 mg de pioglitazona uma vez por dia durante 12 semanas, HbA1c diminuiu 1,08 ± 1,47% (média ± DP de 63 pacientes).
- - Diabetes mellitus tipo II tratados com sulfonilureias, além de dieta e/ou terapia de exercício: Como resultado do tratamento com dose de 30 mg de pioglitazona uma vez por dia durante 12 semanas, HbA1c diminuiu 1,24 ± 1,33% (média ± DP de 56 pacientes).
- - Diabetes mellitus do tipo 2 tratados com inibidores de a-glicosidase, além de dieta e/ou terapia de exercício: Como resultado do tratamento com dose de 30 mg de pioglitazona, uma vez por dia, durante 16 semanas, HbA1c diminuiu de 0,91 ± 0,89% (média ± DP de 55 pacientes).
- - Diabetes mellitus do tipo II tratados com biguanidas, além de dieta e/ou terapia de exercício: Como resultado do tratamento com dose de 15 mg de pioglitazona, uma vez por dia durante 12 semanas, seguidas por 30 mg de pioglitazona, uma vez por dia, durante 16 semanas, HbA1c diminuiu 0,67 ± 0,80% (média f DP de 83 pacientes).
- - Diabetes mellitus tipo II tratados com preparações de insulina, além de tratamento dietético e / ou terapia de exercício: Como resultado do tratamento com dose de 30 mg de pioglitazona uma vez por dia, durante 16 semanas, HbA1c diminuiu 1,22 ± 1,11% (média de f DP de 45 pacientes).
Em um estudo controlado por placebo, os pacientes com controle glicêmico inadequado, apesar de um período de três meses para otimização de insulina, foram randomizados para pioglitazona ou placebo durante 12 meses. Os pacientes que receberam pioglitazona tiveram uma redução média na HbA1c de 0,45% em comparação com os que continuaram a tomar somente insulina e uma redução da dose de insulina no grupo tratado com pioglitazona.
A análise HOMA mostra que a pioglitazona melhora a função das células beta, bem como aumentar a sensibilidade à insulina. Estudos clínicos de dois anos têm demonstrado a manutenção deste efeito.
Em ensaios clínicos de um ano, a pioglitazona promoveu uma redução consistente e estatisticamente significativa na relação albumina/creatinina em relação ao valor basal.
O efeito da pioglitazona (monoterapia 45 mg vs. placebo) foi avaliado em um pequeno estudo de 18 semanas em diabéticos tipo II. A pioglitazona foi associada a ganho de peso significativo. A gordura visceral diminuiu significativamente, enquanto houve um aumento da massa de gordura extra-abdominal. Alterações similares na distribuição da gordura corporal com pioglitazona foram acompanhadas de uma melhora na sensibilidade à insulina. Na maioria dos estudos clínicos, foram observados redução dos triglicérides plasmáticos totais e ácidos graxos livres, e aumento dos níveis de HDL-colesterol quando comparados com placebo, com um pequeno, mas não clinicamente significativo, aumentos nos níveis de LDL-colesterol.
Em estudos clínicos com duração de até dois anos, a pioglitazona reduziu os triglicérides plasmáticos totais e de ácidos graxos livres, e aumentou os níveis de colesterol HDL, comparativamente ao placebo, metformina ou gliclazida.
A pioglitazona não provocou elevações estatisticamente significativas nos níveis do LDL-colesterol, comparativamente ao placebo, enquanto foram observadas reduções com metformina e gliclazida. Em um estudo de 20 semanas, assim como a redução dos triglicérides em jejum, a pioglitazona reduziu a hipertrigliceridemia pós-prandial através de um efeito sobre os triglicérides absorvidos e hepáticos sintetizados. Estes efeitos foram independentes dos efeitos da pioglitazona sobre a glicemia e foram estatisticamente significativamente diferentes da glibenclamida.
População pediátrica
A Agência Europeia de Medicamentos (EMA) dispensou a obrigação de submissão dos resultados dos estudos com cloridrato de pioglitazona em todos os subgrupos da população pediátrica com diabetes mellitus tipo II.
Características Farmacológicas
Propriedades farmacodinâmicas
- - Grupo farmacoterapêutico: tiazolidinodionas;
- - Código ATC: A10BG03.
Mecanismo de ação:
A pioglitazona é uma tiazolidinodiona, que depende da presença de insulina para o seu mecanismo de ação.
A pioglitazona diminui a resistência à insulina na periferia e no fígado, resultando em um aumento da eliminação de glicose insulino-dependente e na diminuição da produção de glicose hepática. A pioglitazona não é um secretagogo de insulina.
A pioglitazona é um agonista do receptor γ de peroxissomo proliferador-ativado (PPARγ). Receptores PPAR são encontrados em tecidos importantes para a ação da insulina, como tecido adiposo, músculo esquelético e fígado. A ativação de receptores nucleares de PPARy modulam a transcrição de um número de genes responsivos à insulina envolvidos no controle da glicose e do metabolismo lipídico.
Em modelos de diabetes em animais, a pioglitazona reduz a hiperglicemia, hiperinsulinemia e hipertrigliceridemia característica de estados de resistência à insulina, tais como diabetes tipo II. As alterações metabólicas produzidas pela pioglitazona resultaram no aumento da capacidade de resposta dos tecidos insulino-dependentes e são observados em diversos modelos animais de resistência à insulina.
Uma vez que a pioglitazona aumenta os efeitos da insulina circulante (por redução da resistência à insulina), ela não diminui a glicose no sangue em modelos animais que não possuem a insulina endógena.
Segurança cardiovascular
Em um estudo clínico de pioglitazona e insulina, placebo-controlado, duplo-cego com 566 pacientes, dois pacientes que receberam pioglitazona 15mg e insulina (1,1%) e dois pacientes que receberam pioglitazona 30mg mais insulina (1,1%) desenvolveram insuficiência cardíaca congestiva (ICC) em comparação com nenhum dos pacientes que receberam somente insulina.
Em outro estudo dose-controlada de pioglitazona coadministrado com insulina, 0,3% (1/345) dos pacientes tratados com 30mg e 0,9% (3/345) dos pacientes tratados com 45mg reportaram ICC como um evento adverso grave. Nestes estudos, não foi identificado nenhum fator específico que poderia prever um risco aumentado de ICC em terapia combinada com insulina.
Um estudo de segurança pós-comercialização comparou a pioglitazona (n = 262) e a glibenclamida (n = 256) em pacientes diabéticos não controlados com insuficiência cardíaca NYHA classe II e III e fração de ejeção menor que 40%.
Internação hospitalar noturna devido a ICC foi relatada em 9,9% dos pacientes tratados com pioglitazona em comparação com 4,7% dos pacientes tratados com glibenclamida. Não houve diferença na mortalidade cardiovascular entre os grupos de tratamento. No estudo PROactive (estudo clínico prospectivo de pioglitazona em eventos macrovasculares), 5.238 pacientes com diabetes mellitus tipo II e uma história prévia de doença macrovascular foram tratados com pioglitazona (n = 2.605), titulação forçada até 45 mg ao dia, ou placebo (n = 2,633), além do atendimento padrão. Quase todos os indivíduos (95%) estavam recebendo medicamentos cardiovasculares (beta-bloqueadores, inibidores da ECA, BRAs, bloqueadores dos canais de cálcio, nitratos, diuréticos, aspirina, estatinas, fibratos). Os pacientes tinham uma idade média de 61,8 anos, duração média do diabetes de 9,5 anos e HbA1c média de 8,1%. A duração média de acompanhamento foi de 34,5 meses. A primeira variável de eficácia foi o tempo para a primeira ocorrência de qualquer evento no desfecho cardiovascular composto que inclui mortalidade por todas as causas, infarto miocardial não-fatal (IM), incluindo IM silencioso, acidente vascular cerebral, síndrome coronariana aguda, intervenção cardíaca, incluindo cirurgia de revascularização miocárdica ou intervenção percutânea, amputação da perna acima do tornozelo, e revascularização da perna.
Um total de 514 (19,7%) dos pacientes tratados com pioglitazona e 572 (21,7%) dos pacientes tratados com placebo apresentaram pelo menos um evento do desfecho primário composto (hazard ratio 0,90; Intervalo de confiança 95%: 0,80, 1,02, p = 0,10). Embora não haja diferença estatisticamente significativa entre a pioglitazona e o placebo para a incidência de um primeiro evento dentro deste composto em 3 anos, não houve aumento na mortalidade nem no número total de eventos macrovasculares com pioglitazona (ver Tabela 10 abaixo). A porcentagem de pacientes que tiveram um caso de insuficiência cardíaca grave foi maior entre os pacientes tratados com pioglitazona (5,7% , n = 149) do que para os pacientes tratados com placebo (4,1% , n = 108).
A incidência de morte na sequência de um relato de insuficiência cardíaca grave foi de 1,5% (n = 40) em pacientes tratados com pioglitazona e 1,4% (n = 37) em pacientes tratados com placebo. Em pacientes tratados com um regime contendo insulina no início do estudo, a incidência de insuficiência cardíaca grave foi de 6,3% (n = 54/864) com pioglitazona e 5,2% (n = 47/896 ) com placebo. Para aqueles tratados com um regime contendo sulfonilureia no início do estudo, a incidência de insuficiência cardíaca grave foi de 5,8% (n = 94 /1,624) com pioglitazona e 4,4% ( n = 71 /1,626) com placebo.

CRM = cirurgia de revascularização miocárdia; IP = intervenção percutânea
Farmacodinâmica
Os estudos clínicos demonstram que a pioglitazona melhora a sensibilidade à insulina em pacientes resistentes à insulina.
A pioglitazona melhora a capacidade de resposta celular à insulina, aumenta a eliminação de glicose dependente de insulina, e aumenta a sensibilidade hepática à insulina. Em pacientes com diabetes tipo II, a redução na resistência à insulina produzida pela pioglitazona resultou em concentrações reduzidas de glicose no plasma, concentrações mais baixas de insulina no plasma e valores mais baixos de HbA1c. Em estudos clínicos controlados, a pioglitazona teve um efeito aditivo sobre o controle glicêmico, quando usado em combinação com sulfonilureia, metformina ou insulina.
Pacientes com anormalidades lipídicas foram incluídos em estudos clínicos com pioglitazona. Em geral, os pacientes tratados com pioglitazona tiveram reduções médias nos triglicérides sérico, aumentos médios no HDL colesterol, e sem alterações médias consistentes em LDL e colesterol total. Não há nenhuma evidência conclusiva de benefício macrovascular com pioglitazona ou com qualquer outro medicamento antidiabético.
Propriedades farmacocinéticas
Absorção:
Após administração oral de pioglitazona o pico de concentração foi observado dentro de 2 horas. Alimentação retarda ligeiramente o tempo do pico da concentração sérica (Tmax) para 3 a 4 horas, mas não altera a extensão da absorção (ASC) (Estudo PNFP-036). A biodisponibilidade absoluta de pioglitazona é maior que 80% (Estudo EC-241).
Após a administração de pioglitazona uma vez ao dia, as concentrações séricas no estado de equilíbrio de ambos, pioglitazona e seus principais metabólitos ativos, M-III (derivado ceto de pioglitazona) e M-IV (derivado de hidroxila de pioglitazona), são alcançados dentro de 7 dias.
No estado de equilíbrio, M-III e M-IV atingiram concentrações séricas iguais ou maiores do que a de pioglitazona. No estado de equilíbrio, nos voluntários sadios e nos pacientes com diabetes tipo II, a pioglitazona compreende cerca de 30% a 50% do pico total de concentração sérica (pioglitazona mais metabólitos ativos) e 20% a 25% de ASC total. No estado de equilíbrio, a pioglitazona e seus metabolitos não parecem acumular (Estudo CPH-002).
A concentração sérica máxima (Cmáx), ASC e concentrações séricas mínimas (Cmin) de pioglitazona e M-III e M-IV aumentaram proporcionalmente com doses administradas de 15 mg e 30 mg por dia.
Distribuição
O volume aparente de distribuição médio da pioglitazona após administração de uma única dose é de aproximadamente 0,25 a 0,63 L/kg de peso corpóreo. A pioglitazona e todos os metabólitos ativos se ligam extensamente às proteínas do soro humano (>99%), principalmente à albumina sérica. A pioglitazona também se liga a outras proteínas séricas, mas com menor afinidade. Os metabólitos M-III e M-IV também se ligam extensamente à albumina sérica (>98%).
Metabolismo
A pioglitazona é extensamente metabolizada por hidroxilação e oxidação. Os metabólitos também se convertem parcialmente em glicuronídeos ou conjugados sulfatados. Dados in vitro demonstram que as múltiplas isoformas CYP estão envolvidas no metabolismo de pioglitazona. As isoformas do citocromo P450 envolvidas são CYP2C8 e, em menor grau, CYP3A4 com contribuições adicionais de uma variedade de outras isoformas incluindo a principal extra-hepática CYP1A1. Três dos seis metabólitos identificados são ativos (M-II, M-III e M-IV). Quando em atividade, considerando as concentrações e a ligação a proteínas, a pioglitazona e o metabólito M-III contribuem igualmente para a eficácia. Nesta base, a contribuição de M-IV para eficácia é aproximadamente três vezes a da pioglitazona, enquanto que a contribuição relativa de M-II é mínima.
Estudos in vivo de pioglitazona em combinação com genfibrozila, um forte inibidor de CYP2C8 mostrou que a pioglitazona é substrato da CYP2C8.
Estudos in vivo não demonstraram evidências que a pioglitazona inibe qualquer subtipo do citocromo P450. Não há indução das principais enzimas indutíveis CYP1A, CYP2C8/09 e CYP3A4 no ser humano.
As razões de cortisol/6β-hidrocortisol urinários medidas em pacientes tratados com este produto mostraram que a pioglitazona não é um forte indutor da enzima CYP3A4.
Estudos de interação mostraram que a pioglitazona não possui efeito relevante na farmacocinética nem na farmacodinâmica de digoxina, varfarina, femprocumona e metformina. Foi relatado que a administração concomitante de pioglitazona com genfibrozila (um inibidor de CYP2C8) ou com rifampicina (um indutor de CYP2C8) aumenta ou reduz, respectivamente, a concentração plasmática de pioglitazona.
Excreção e eliminação
Após administração oral, aproximadamente 15% a 30% da dose de pioglitazona é recuperada na urina. A eliminação renal da pioglitazona é insignificante e a droga é principalmente excretada na forma de metabólitos e seus conjugados. Presume-se que a maior parte da dose oral seja excretada na bile, na forma inalterada ou na forma de metabólitos, e eliminada nas fezes. A meia-vida sérica média da pioglitazona e de seus metabólitos (M-III e M-IV) varia de 3 a 7 horas e de 16 a 24 horas, respectivamente. A pioglitazona tem uma depuração aparente calculada em 5 a 7 L/h.
Após administração oral de pioglitazona radiomarcada no ser humano, a taxa de recuperação foi principalmente nas fezes (55%) e uma quantidade menor na urina (45%). A meia-vida de eliminação plasmática média da pioglitazona inalterada no ser humano é de 5 a 6 horas e para o total de metabólitos ativos, 16 a 23 horas.
Populações especiais
Insuficiência renal
A meia-vida de eliminação sérica da pioglitazona, M-III e M-IV permanece inalterada em pacientes com insuficiência renal moderada (depuração de creatinina de 30 a 50 mL/min) a grave (clearance de creatinina <30 mL/min) quando comparados com indivíduos com pacientes com função renal normal. Portanto, não é necessário ajuste da dose em pacientes com insuficiência renal (Estudo EC-230).
Insuficiência hepática
Comparado com controles saudáveis, pacientes com função hepática insuficiente (Grau Child-Turcotte-Pugh B/C) apresentam aproximadamente 45% de redução de pico de concentração média de pioglitazona e pioglitazona total (pioglitazona, M-III e M-IV), mas não há alterações nos valores médios de ASC. Dessa forma, não é necessário ajuste de dose em pacientes com insuficiência hepática.
Há relatos pós-comercialização de insuficiência hepática com pioglitazona e ensaios clínicos têm geralmente excluídos pacientes com níveis séricos de TGP maior que 2,5 vezes o limite superior do intervalo de referência. Utilizar este produto com cautela em pacientes com doença hepática (Estudo PNFP-007).
Pacientes geriátricos
Em pacientes idosos saudáveis, os picos de concentrações séricas de pioglitazona não são significativamente diferentes, mas os valores da ASC são aproximadamente 21% maior aos obtidos em indivíduos mais jovens. Os valores de meia-vida média terminal de pioglitazona também foram mais longos em indivíduos idosos (cerca de 10 horas), em comparação com indivíduos mais jovens (cerca de 7 horas). Estas mudanças não foram de uma magnitude que possa ser considerada clinicamente relevantes (Estudo PNFP-025).
Pacientes pediátricos
A segurança e eficácia de pioglitazona em pacientes pediátricos não foram estabelecidas. Este produto não é recomendado para uso em pacientes pediátricos.
Gênero
Os valores médios de Cmáx e ASC da pioglitazona foram elevados de 20% a 60% nas mulheres em relação aos homens (Estudo PNFP-025). Em ensaios clínicos controlados, reduções de HbA1c em relação aos valores basais foram geralmente maior para as mulheres do que para os homens (diferença média na HbA1c de 0,5%).
Porque o tratamento deve ser individualizado para cada paciente para atingir o controle glicêmico, não é recomendado qualquer ajuste da dose com base somente no gênero do paciente.
Etnia
Dados farmacocinéticos entre vários grupos étnicos não estão disponíveis.
Interações entre fármacos

*Diariamente por 7 dias salvo disposição ao contrário.
† % de alteração (com ou sem coadministração de fármaco e sem alterações = 0%); símbolos de ↑ e ↓ indicam o aumento ou redução da exposição, respectivamente.
‡ A pioglitazona não possui efeito clínico significante no tempo de protrombina.

*Diariamente por 7 dias salvo disposição ao contrário.
Razão média (com/sem fármaco coadministrado e sem alteração = 1 vez);
% de alteração (com ou sem coadministração de fármaco e sem alterações = 0%); símbolos de ↑ e ↓ indicam o aumento ou redução da exposição, respectivamente.
A meia-vida de pioglitazona elevou de 8,3h para 22,7h na presença de genfibrozila.
Dados de segurança pré-clínica:
Segurança farmacológica
Uma série de estudos de segurança farmacológica foi realizada com pioglitazona à procura de potenciais efeitos adversos sobre o sistema cardiovascular, sistema respiratório, sistema nervoso central, sistema nervoso autônomo e função gastrointestinal. Não foram observados resultados significativos.
Mutagenicidade, carcinogenicidade
A pioglitazona foi desprovida de potencial genotóxico em uma série completa de ensaios de genotoxicidade in vivo e in vitro. Um aumento na incidência de hiperplasia (em machos e fêmeas) e de tumores (em machos) do epitélio da bexiga foram verificados em ratos tratados com pioglitazona por até 2 anos.
Um estudo posterior mecanístico subsequente de 2 anos em ratos foi conduzido para determinar o efeito da acidificação da urina na redução ou eliminação da formação de cristais urinários, que pode ser a causa subjacente dos tumores observados em ratos do gênero masculino. Embora as alterações proliferativas ainda foram observadas, a incidência de tumores, em animais que receberam uma dieta concebida para acidificar a urina, foi reduzida. Não houve resposta tumorigênica em ratos de ambos os gêneros. Hiperplasia da bexiga urinária não foi observada em cães ou macacos tratados com pioglitazona por até 12 meses.
ONDE, COMO E POR QUANTO TEMPO POSSO GUARDAR ESTE MEDICAMENTO Este medicamento deve ser mantido em temperatura ambiente (15ºC a 30°C), protegido da luz e da umidade Número de lote e datas de fabricação e validade: vide embalagem Não use medicamento com o prazo de validade vencido Guarde-o em sua embalagem original Os comprimidos de Stanglit® são circulares, biconvexos, lisos e de coloração verde clara Antes de usar, observe o aspecto do medicamento Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo Todo medicamento deve ser mantido fora do alcance das crianças 6
Uso adulto.
Cintia Delphino de Andrade – CRF-SP nº: 25.125
| Receita | Sim,Branca Comum |
| Bula | Veja a Bula |
| Tipo do medicamento | Similar Equivalente |
| Princípio Ativo | Cloridrato de Pioglitazona |



